(Ne)dostupnosť liekov
Pridané: 25. 01. 2021
PRINT, dátum: 01/2021, zdroj: Lekárnické listy
Dostupnosť liekov predstavuje jeden zo základných pilierov úspešnej liečby pacientov. K tejto nevyhnutnosti významným spôsobom prispelo aj zavedenie legislatívnej normy na zriadenie emergentného systému od 1. apríla 2017. Žiaľ, ani táto povinnosť, najmä pre držiteľov registrácie, nie je vždy všeliekom k zabezpečeniu naordinovanej liečby chorému. Svoj rukopis však na dostupnosti medikamentóznej liečby na Slovensku, okrem neočakávanej pandemickej situácie zanecháva aj preregulované a nepredvídateľné legislatívne prostredie. Asociácia GENAS dlhodobo poukazuje na viacnásobnú reguláciu cien generických a biosimilárnych liekov na Slovensku.
Ministerstvo zdravotníctva SR dvakrát ročne referencuje ceny generických a biosimilárnych liekov podľa priemeru 3 najnižších cien v EÚ s cieľom dosiahnuť pravidelné úspory výdavkov na lieky. Týmto procesom, okrem jednoznačne definovaných kritérií pre trojpraho vý vstup generických (- 45 %, - 10 %, - 5 % z ceny pre každý ďalší liek) a biosimilárnych (- 25 %, - 5 %, - 5 %) liekov, ako aj s legislatívou podporeným nesystémovým znižovaním cien liekov pri revízii úhrad, slovenský trh negatívne ovplyvňuje ceny liekov v 14 krajinách EÚ.
Táto pravidelná cenová erózia vnáša nielen nepredvídateľnosť podmienok pre farmaceutické spoločnosti (držiteľov rozhodnutia o registrácii), ale často má za následok zo strany výrobcov vyňatie lieku z kategorizačného zoznamu (až deregistráciu), alebo u nového generika alebo biosimilárneho lieku aj zrušenie možného vstupu na slovenský trh, čo ohrozuje efektívne využívanie zdrojov verejného zdravotníctva (širším využívaním generických a biosimilárnych liekov). Ani všetky tieto opatrenia spolu nepriniesli plánovanú úsporu vo výdavkoch na lieky tak, ako bol ich účel popísaný v dôvodovej správe pri novelizácii zákona č. 363/2011 Z. z. s účinnosťou od 1. 1. 2018. Významným spôsobom však prispeli k prehodnoteniu možného vstupu nových generických a biosimilárnych liekov na náš trh, čo dokazuje aj klesajúci trend podaných žiadostí o zaradenie do Zoznamu kategorizovaných liekov. Žiaľ, trojprahové vstupné podmienky sa vzťahujú aj na nové balenia k už zaradenému generickému/biosimilárnemu lieku, napriek tomu, že v prípade vstupu nového balenia originálneho lieku cenový pokles sa nevyžaduje.
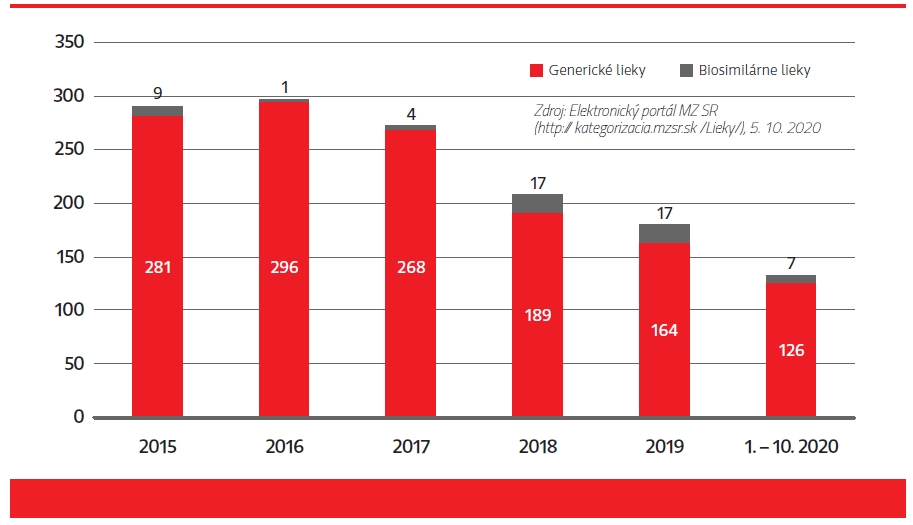
V procese referencovania cien liekov u nás definovaný referenčný kôš zahŕňa aj severské krajiny EÚ, pre ktoré je charakteristický iný úhradový systém v podobe mesačne sa meniacich tendrových cien, ktoré takto negatívne ovplyvňujú nielen cenu, ale aj dostupnosť generických liekov na Slovensku. Ako príklad môžeme uviesť molekuly štandardne používané v rámci onkologických liečebných režimov (antivirotiká), esenciálne cytostatiká, ktoré sú následne nesystémovo riešené režimom mimoriadneho dovozu. Aj Výzva MZ SR adresovaná držiteľom registrácie onkologických liekov zo dňa 18. 12. 2019 s požiadavkou o zváženie registrácie a následné podanie žiadosti o zaradenie lieku do Zoznamu kategorizovaných liekov a úradné určenie ceny lieku, najmä liekov s účinnou látkou cisplatina, fluoruracil, irinotekan, docetaxel, temozolomid, zdôrazňuje závažnosť situácie.
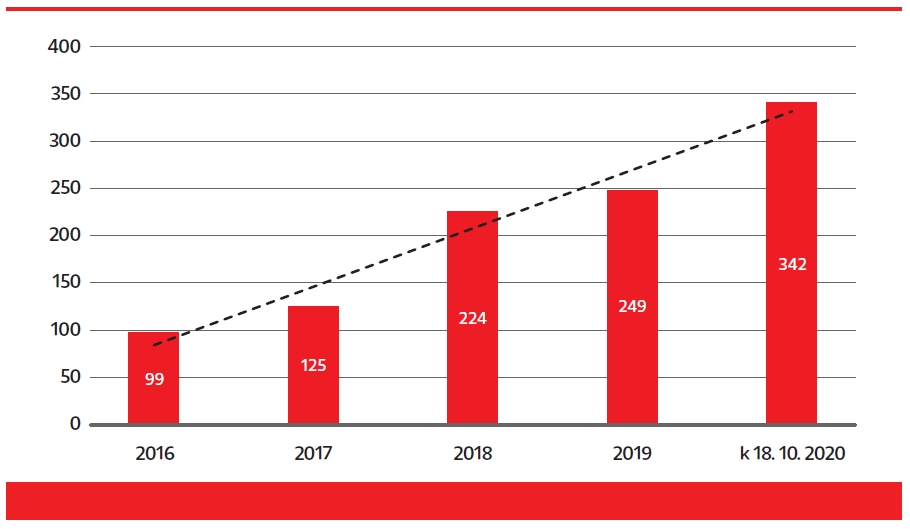
Nielen frekvencia procesu referencovania (2-krát ročne), ale aj metodológia decimuje cenu/úhradu kategorizovaných liekov, lebo porovnávanie veľkostí balení cez jednotkovú cenu, okrem vytvorenia prekážky pre vstup na trh, zvyšuje aj nepredvídateľné riziko ukončenia dodávania celých skupín liekov na náš trh. Cena generického lieku je znižovaná pri vstupe, referencovaním, revíziou úhrad i tendrovaním zdravotnými poisťovňami. Slovensko sa tak stáva pre výrobcov generických liekov a biosimilárnych liekov viac a viac neatraktívnym trhom, čo priamo ohrozuje dostupnosť liekov.
V zmysle výstupov analýzy inštitútu INEKO z októbra 2020 „Analýza stavu a možností širšieho využívania gene - rických a biosimilárnych liekov na Slovensku“: z ekonomického pohľadu má regulácia cien zmysel, pokiaľ nie je predpoklad, že férová súťaž vygeneruje trhovú cenu. Ak je na trhu viac konkurujúcich subjektov a štátne orgány minimalizujú riziko kartelu, cenová regulácia nie je potrebná. Rizikom vysokých povinných zrážok z ceny je zníženie motivácie výrobcov vstúpiť na trh. To platí osobitne, ak sú zrážky kombinované s prísnou reguláciou cien, napríklad na základe tzv. referencovania, teda porovnávania cien v iných štátoch. Preto je dôležité pravidelne vyhodnocovať dopady regulácie na vstup nových liekov na trh.
Na základe odporúčania európskej cenovej informačnej databázy EURIPID z februára 2017 navrhujeme revíziu systému referencovania vyhlasovať raz ročne a to iba pre tie lieky, ktoré sú zaradené v kategorizácii menej ako 36 mesiacov. Prehodnotiť význam existencie tzv. 3-prahových vstupných kritérií, vrátane vstupu nových balení k už zaradenému generickému/ biosimilárnemu lieku do kategorizácie, ako aj výšku povinných zrážok z cien. Predovšetkým v referenčných skupinách s potenciálom vstupu viacerých konkurenčných liekov je regulácia cien z ekonomického pohľadu neopodstatnená. Príliš vysoké zrážky z ceny v kombinácii s prísnymi podmienkami tzv. medzinárodného referencovania cien môžu motivovať výrobcov, aby odďaľovali vstup lieku na slovenský trh v snahe udržať cenu v iných štátoch na vyššej úrovni.
MUDr. Terézia Szádocka, MPH GENAS – Asociácia pre generické a biosimilárne lieky